ATF: ir baterija, ir neuromediatorius
Adenozintrifosforinė rūgštis arba tiesiog adenozintrifosfotas (ATF) dažniausiai pateikiamas kaip universalus kuras daugybei molekulinių mašinų ir cheminių reakcijų mūsų organizmo ląstelėse. Jo jos nebūtų įmanoma pati gyvybė tuo pavidalu, kokiu ją turime. Tačiau ATF turi ir kitą paskirtį ji padeda perduoti impulsus nervuose? Kaipgi ląstelių kuras virsta neuromediatoriumi?
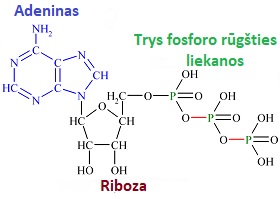 Pradžioje ATF šaltiniu tebuvo glikolizės1), nerūgštinio gliukozės oksidavimosi, procesas citoplazmoje. Toks būdas buvo neefektyvus ir
galėjo aprūpinti energija tik prokariotus. Ląstelėse atsiradus mitochondrijoms ATF gaminimas perėjo į
naują lygį. Jose jis vyksta Krebso ciklo dėka. Ląstelėse ATF pagausėjo ir per parą mūsų kūne jo sunaudojama ir vėl susintetinama kilogramais.
Pradžioje ATF šaltiniu tebuvo glikolizės1), nerūgštinio gliukozės oksidavimosi, procesas citoplazmoje. Toks būdas buvo neefektyvus ir
galėjo aprūpinti energija tik prokariotus. Ląstelėse atsiradus mitochondrijoms ATF gaminimas perėjo į
naują lygį. Jose jis vyksta Krebso ciklo dėka. Ląstelėse ATF pagausėjo ir per parą mūsų kūne jo sunaudojama ir vėl susintetinama kilogramais.
Bet dar nuostabiau pasirodė tai, kad ir ATF molekulė, ir jos kuro atliekos, susidariusios sutrūkus fosforo ryšiams, yra signalinio aparato dalimi. Toji iš senų laikų atėjusi signalizacijos sistema apima visą organizmą ir iniciuoja sudėtingus ląstelinius procesus. Ji mums pasako, kada reikia eiti miegoti, ir ji priverčia surikti iš skausmo. Veikdama ląstelių imuniteto tarnyboje, ji gali tiek išgelbėti organizmą nuo infekcijos, tiek sukelti ląstelių žūtį, tapdama daugelio uždegimų priežastimi. Tik ši jos funkcija nustatyta ne iškart...
20 a. 7-o dešimtm. pradžioje britų neurobiologas Džefris Biornstokas2) (1929-2020), būdamas Australijoje, tyrė jūrų kiaulytės žarnyno muskulatūros sudirginimą elektros srove. Tuo metu atsirado nauji elektrocheminiai metodai ir jam knietėjo juos išbandyti. Jis norėjo sužinoti, kaip lygieji raumenys reaguos į srovę esant visiškai užblokuotiems visiems žinomiems receptoriams. Paprastai nedominantys receptoriai blokuojami neurotoksinais, kurie gaunami iš augalų ir gyvūnų nuodų (bei sintetinių), o tada nagrinėjami likusieji. Dž. Biornstokas audinį apdorojo sintetiniu 6-hidroksidofaminu neurotoksinu ir jį pripildė antropino. Tada įvedė elektrodą ir stimuliavo audinį trumpu elektros impulsu. Buvo tikimasi, kad lygieji raumenys susitrauks, tačiau nieko panašaus neįvyko kažkokia nežinoma jėga priešinosi elektros srovės impulsams ir iniciavo procesus, trukdančius susitraukti raumenims. Buvo stebima hiperpoliarizacija, o raumenys atsipalaiduodavo net duodant tokių impulsų seriją.
Laimei, Dž. Biornstokas dirbo su japonu aspirantu, kuris, pasinaudojęs ryšiais tėvynėje, gavo tetrodotoksino iš fugu žuvies jisai geba blokuoti nervų pralaidumą ir tarsi kamštis užkemša natrio kanalus. Tačiau jis neatima galimybės susitraukti lygiesiems raumenims. Pagaliau, reakcija buvo tokia, kokios tikėtasi hiperpoliarizacija dingo, o raumenys susitraukdavo. Išvada buvo aiški žarnyno lygiuosiuose raumenyse esama nežinomų receptorių, trukdančių susitraukimui ir stabdančių impulsą. Imta ieškoti medžiagos, galinčios tapti tų paslaptingų receptorių aktyvatoriumi.
|
Hiperpoliarizacija ir veikimo potencialas Ramybės būsenoje palei neurono membraną susidaro įvairūs elektrocheminiai potencialai ląstelės viduje neigiamas, o išorėje teigiamas. Kilus nerve signalui atsiveria joniniai kanalai, į citoplazmą įleidžiantys teigiamus kalcio ir natrio jonus. Tokiu būdu neigiamas krūvis ląstelėje pasislenka į teigiamą pusę, įvyksta depoliarizacija. Neuronas veikia pagal principą viskas arba nieko. Kai tik vidinis potencialas pasiekia tam tikrą teigiamumo lygį, juo banguotai nubėga elektrinis impulsas veikimo potencialas. Lygiagrečiai reikia stabdantys joniniai kanalai, kurie pradeda išleidinėti teigiamus kalio jonus arba įsileidinėti neigiamus chloro jonus, trukdydami impulso iniciavimui. Toks virvės traukimas padeda suformuoti adekvatų atsaką į gautą stimulą. Perdavus signalą erdvė ląstelės viduje grįžta į buvusią neigiamą būseną prasideda repoliarizacijos fazė. Potencialų skirtumą galima paslinkti dirbtinai elektros srovės pagalba. Tad net negyvo organizmo raumenų audiniai susitraukia nuo elektros krūvio. Dž. Biornstokas savo bandymuose stebėjo hiperpoliarizaciją žymų poslinkį į neigiamą pusę, kai veikimo potencialo perdavimas neįmanomas. Tai reiškė, kad audiniuose yra nežinomų receptorių, liekančių neužblokuotais ir tebevykdančiais stabdymo funkciją. |
Ieškomas neuromediatorius privalo tenkinti tam tikrus kriterijus. Išbandyti neuropeptidai, monoaminai ir aminorūgštys jų netenkino. Kaip dažnai būna, sprendimas buvo panosėje mat jau senokai nemažai tyrinėtojų jau buvo užsirovę ant keisto užląstelinių purinų poveikio širdies raumeniui ir kraujotakos sistemai, tačiau to nesureikšmino. Pvz. vengrų kilmės Nobelio premijos laureatas Albertas Sent-Djodjė3) (pirmąkart išskyręs vitaminą C) irgi atliko fundamentalius raumenų susitraukimo tyrimus ir 1929 m. darbe pažymėjo, kad purinų junginių įleidimas į gyvūnų kraują paveikia širdies ritmą. Vėliau, 1959-ais, Pamela Holton iš Didžiosios Britanijos pastebėjo, kad ATF išskiriamas stimuliuojant nervus triušio ausų arterijose ir sukelia kraujagyslių sienelių atsipalaidavimą. Tačiau jie nėjo gilyn ir nesiaiškino, o kokio gylio ta triušio ola?
Pasinaudodamas tomis žiniomis Dž. Biornstokas su kolega Deividu Setčelu4) įrodė, kad ATF iš tikro aktyvina tiek stimuliuojančius, tiek slopinančius efektus įvairių tipų audiniuose ir tai paskelbė 1970 m. British J. of Pharmacology. Tuo metu tapo žinoma ir apie užląstelinius fermentus, galinčius skaidyti ATF. Tad Dž. Biornstokas pasirinko ATF kaip neuromediatorių jo atrastiems receptoriams ir iškėlė hipotezę purinergetinį signalo perdavimą.
Grįžęs į Angliją Dž. Biornstokas susidūrė su kolegų nepasitikėjimu. Tuo metu buvo populiarus vadinamasis Deilo principas kad neuronas gali atlikti signalo perdavimą tik vieno neurotransmiterio (pvz., acetilcholino) pagalba. O kad visur esanti molekulė, o dar ir ląstelių energijos šaltinis, galėtų dalyvauti subtiliuose nervų veiklos reguliavimo procesuose, atrodė mažai tikėtina. 1972 m. Dž. Biornstokas paskelbė dar vieną išsamų apžvalginį straipsnį, sukėlusį nemažą rezonansą ir debatus. Vis tik jis dar apie 20 m. jautė pasipriešinimą, tačiau nesmuko dvasia ir užsispyręs tęsė darbus.
Kitu žingsniu reikėjo išsiaiškinti, kas tai per receptoriai, kurie gali būti aktyvinami ATF ar jo suirimo produktais. Tuo metu išskirti ir nustatyti jų struktūrą nebuvo įmanoma. Beliko veikti apčiuopomis, t.y. kruopščiai kaupti duomenis ir juos lyginti. 1978 m. jam pavyko išsiaiškinti, kad tuos receptorius galima pagal farmakologinius požymius išskirstyti į dvi šeimas (je susidarė pradinio geno mutacijų metu): sąlyginai pavadintas P1 ir P2. P1 buvo blokuojami metilksantinų ir aktyvinami adenozino, o P2 daugiausia reagavo į ATF ir metilksantinai jų neveikė.
Galiausiai molekulinio klonavimo išsivystymas leido geriau įsižiūrėti į purino-receptorius o kartu patikėjo ir Dž. Biornstoku. Naujus receptorius tyrinėti puolė visi. Purinergetinį signalo perdavimą pradėjo vadinti ATF antruoju gyvenimu arba profesija. Rentgeninės kristalografijos ir elektroninės mikroskopijos dėka 21 a. pradžioje buvo paruoštos trimatės receptorių struktūros.
Purinergetinis signalo perdavimas vyksta ne tik neuromediacijoje. Toji sistema apima visus lygius: jie atsakingi už jutimą, skausmą, širdies ritmą, lygiųjų raumenų susitraukimus, tulžies ir endokrininių hormonų išskyrimą ir t.t. Paaiškėjo, kad vienas neuronas savo nervų gale gali naudoti kelis skirtingus receptorius bei neuromediatorius.
Adenozintrifosfotas pirmiausia paveikia P2X šeimos transmembraninius joninius kanalus. Šie receptoriai akimirksniu aktyvuoja veiksmo potencialą neuronais, o taip pat gali aktyvuoti įvairius biocheminius kelius.
Organizme, įskaitant nervų sistemą, rasti 7-ios P2X receptorių atmainos, tačiau jie pasiskirstę netolygiai ir skirtingos ląstelės turi skirtingus jų rinkinius. Ląstelės tipas nusako receptorių rinkinio sudėtį ir jų funkcijas, kurios labai įvairios. Jų DNR 20 a. pabaigoje ištyrė britų grupė vadovaujama Ričardo Alano Norto5).
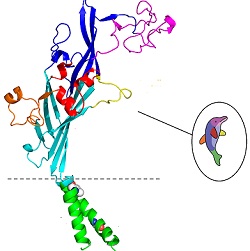 2009 m. įvyko naujas postūmis juos tiriant, kai amerikiečių grupė vadovaujama Tosimicu Kavatė6)
rentgenostruktūrinės analizės pagalba sukūrė P2X4 receptoriaus iš Danio rero žuvelės 3D struktūrą. Joninis
kanalas pasirodė esąs trimeriu, sudarytu iš trijų baltymų molekulių, kurių aminorūgščių seka nusako P2X receptoriaus
tipą. Visos trys dalys gali atsiverti ir užsiverti tarsi plokštelės ant fotoaparato objektyvo. Tačiau nuostabiausia, kad
kiekviena sudedamoji priminė delfiną. Trys ATF molekulės įsitaiso kišenėse tarp dviejų delfinų ir atidaro joninį kanalą.
2009 m. įvyko naujas postūmis juos tiriant, kai amerikiečių grupė vadovaujama Tosimicu Kavatė6)
rentgenostruktūrinės analizės pagalba sukūrė P2X4 receptoriaus iš Danio rero žuvelės 3D struktūrą. Joninis
kanalas pasirodė esąs trimeriu, sudarytu iš trijų baltymų molekulių, kurių aminorūgščių seka nusako P2X receptoriaus
tipą. Visos trys dalys gali atsiverti ir užsiverti tarsi plokštelės ant fotoaparato objektyvo. Tačiau nuostabiausia, kad
kiekviena sudedamoji priminė delfiną. Trys ATF molekulės įsitaiso kišenėse tarp dviejų delfinų ir atidaro joninį kanalą.
Purininiai ir pirimidiniai nukleotidai atsirado dar prebiotiniais laikais ir tapo biotinės epochos priežastimi: juk be jų nebūtų atsiradę DNR ir RNR. ATF jau ankstyvaisiais etapais tapo energijos šaltiniu visiems organizmams ir jo dėka susikūrė universali signalinė sistema, pagrįsta kalcio jonais. Būtent kalcio, nes pagal gamtos užgaidą kalcio citoplazmoje turi būti ypač mažai, nes kitaip susidarytų netirpūs fosfatai. Tad į ląstelę patenkantis kalcis turi būti panaudojamas fiziologiniuose procesuose ir tada pašalinamas iš jos. Tai ir suteikė jam antrojo mesendžerio vaidmenį. Čia dar įsiterpia ir teorija apie pirmapradžio vandenyno padidintą šarmingumą (juk gyvybė pradėjo vystytis būtent tokiomis sąlygomis), kuriame kalcio jonų buvo mažai (dėl mažo kalcio hidroksidų tirpumo). Mūsų ląstelėse didesnė kalcio dalis sutelkta endoplazminio retikulumo kalcio depozituose, iš kurių jis išskiriamas signalo perdavimui, o taip pat gali patekti iš išorės per joninius kanalus (tokius kaip P2X).
P2X1 ir P2X4 yra receptoriai, kuriuos paveikdami galime sumažinti širdies-kraujagyslių susirgimų riziką, tad jie gana perspektyvūs taikiniai naujų vaistų sukūrimui. P2X4 ir P2X7 vaidmuo svarbus ląstelių imunitetui, uždegimams ir programuojamai ląstelių žūčiai jų gausu daugelyje imuninių ląstelių, tokių kaip <makrofagai, dendritai ir riebalinės ląstelės. Be jų neišsiverčia nė vienas infekcinis susirgimas, jokia trauma ar netikėta alerginė reakcija. Šių receptorių sutrikimams jau priskiria visą krūvą susirgimų reumatinį artritą, diabetą, cirozes ir fibrozes, alergijas, Krono, Alzheimerio ir Parkinsono ligas, infarktus ir insultus, vėžį ... Net psichiatrai pradėjo įsižiūrėti į P2X7 padidinti jo kiekiai smegenyse stebimi pas kenčiančius nuo depresijos, bipoliarinio sutrikimo ir aštrios formos psichozės. Perteklinis P2X4 ir P2X7 aktyvinimas mikroglijoje gali sukelti neuroninį uždegimą, kuris gali pasibaigti neuronų žūtimi ir paralyžiumi.
Apie P2X7 verta pakalbėti atskirai. Į mokslininkų akiratį patekęs 1980-ais jis juos gerokai suglumino. Jis mažiau jautrus ATF, bet kai šio labai gausu ir jis pasirodo pastoviai, per jį pradeda įeiti kalcis ir išeiti kalis taip imuninėms ląstelėms pranešama, kad reikia ruošti sunkiąją artileriją ir pilna jėga štampuoti priešuždegiminius citokinus. Esant ilgam ATF poveikiui, atsiveria plati pora, galinti praleisti stambias molekules (iki 900 daltonų). Ilgam atverta tokia pora sukelia neurozę arba apoptozę. Tačiau tokia P2X7 savybė gali būti ir naudinga, jei dėl kai kurių priežasčių reikia nužudyti ląstelę (pvz., vėžinę).
Blokatorių yra įvairių. Prie metilksantinų priskiriamas ir kofeinas - būtent dėl jo kava mus stimuliuoja. Tačiau stipriai pripratus prie kavos, nervų sistema ima galinti daugiau adenizinių receptorių. Jei liaunamasi gerti kavą adenozinas užima atsilaisvinusią vietą ir mes pradedame labiau jausti mieguistumą be įprastinės žvalinančio gėrimo dozės. Mat metilksantinai struktūriškai panašūs į adenoziną ne ribozės toliu lygiu, kad receptoriai nepastebi pakaitalo ir priima padirbinį taip gaudami kamštį.
Kita įdomi išvada gauta nagrinėjant akupunktūrą. Tvirtinama, kad ji stimuliuoja adenozino išskyrimą. O šis veikia P1A1 receptorių ir padeda sumažinti skausmą bei uždeginius procesus. Aišku, tame neapeinant ATF. Atrodo, kad akupunktūra įgauna mokslinį patvirtinimą...
Įdomu ir tai, kad musgaudis augalas suglaudžia savo spąstus sureaguodamas į ATF, - kai vabzdys paliečia jautrius plaukelius, šie suaktyvina ATF išleidimą į užląstelinę aplinką, o tada suveikia veikimo potencialas ir augalas užsiveria, palikdamas musę viduje. Mažiausias ATF dozes jūros vandenyje pajunta omarai o tai simbolizuoja apie sužeistą auką ir šviežią maistą jiems tai tarsi mums šviežiai iškeptos bandelės kvapas.
1) Glikolizė (iš gr. glykys - saldus ir lysis - atskyrimas) pirmasis ląstelinio kvėpavimo etapas, vykstantis citozolyje, kurio metu gliukozė suskyla į dvi piruvato molekules. Šiame procese Išlaisvinta energija panaudojama kuriant daug energijos turinčius junginius: ATP ir NADH. Jo vykimui nereikalingas deguonis. Aerobinėmis sąlygomis pirovatinė rūgštis įtraukiama į Krebso procesą, o anaerobinėmis sąlygomis atsistato iki pieno rūgšties arba toliau skyla vykstant rūgimo procesui.
2) Džefris Biornstokas (Geoffrey Burnstock, 1929-2020) anglų neurobiologas, plačiausiai žinomas termino purininis signalizavimas įvedimu. Nuo 1959 m. dėstė Melburno un-te. 8-me dešimtm. pasižymėjo pagrindiniu vaidmeniu nustatant ATF esant neurotransmiteriu. Buvo Purinergic Signalling žurnalo vyr. redaktoriumi. Religinėmis pažiūromis buvo ateistu.
3) Albertas Sent-Djodjė (Albert Imre Szent-Gyorgyi, 1893-1986) vengrų biochemikas, Nobelio
premijos laureatas (1937). Buvo aktyvus pasipriešinimo dalyvis Antrojo pasaulinio karo metu. Į JAV emigravo 1947 m. Jo
didžiausi pasiekimai vitaminų oksidacijos-redukcijos reakcijos srityje; jam priskiriamas vitamino C išskyrimas (1931).
1937 m. jis buvo arti visų ATF molekulės sintezės etapų nustatymo jo klaida buvo, kad jis pernelyg didelį dėmesį
sutelkė obuolių rūgščiai ir oksaloacetatui, kai netrukus H. Krebsas išsiaiškino, kad svarbiausia grandimi yra citrinos
rūgštis. Ir vėliau didelį dėmesį skyrė raumenų darbui, o paskutinius metus skyrė darbui su biofizikais.
4) Deividas Setčelas (David Satchell) australų neurobiologas, kuris specializuojasi atminties ir uoslės sutrikimų srityje. Skaito paskaitas Melburno un-to Zoologijos fakultete. Jo moksliniai interesai apima ir purino junginių poveikio lygiųjų raumenų tyrimus bei žarnyno ir kvėpavimo takų inervacijos tyrimus.
5) Ričardas Alanas Nortas (Richard Alan North, g. 1944 m.) britų biomedikas, Mančesterio un-to profesorius. Jo tyrimai buvo fiziologijos, farmakologijos ir neuromokslo sankirtoje. Jis parodė, kad opiatai, o taip pat kiti amino ir peptidiniai neurotransmiteriai skatina neuronų aktyvumą atverdami kalio joninius kanalus ląstelių membranoje. Buvo entuziastingas alpinistas, atlikęs kelis pirmuosius pasikėlimus arba atradęs naujus kelius į Uperniviko salos (Grenlandijoje) bei kitur kalnų viršūnes.
6) Tošimicu Kavatė (Toshimitsu Kawate) japonų kilmės molekulinės medicinos specialistas, Kornelio un-to profesorius. Nagrinėja tarpląstelinius signalų perdavimus, kuriuos kontroliuoja daugybė baltymų. Tiria kaip susidaro tie baltymai, kaip perduoda ir gauna signalus bei perduoda juos per ląstelės membraną; atskiru atveju domina joniniai kanalai kartu su ATF.
Milžinai Žemėje
Jei žūtų Žemė?..
Gyvybės paieškos
Kadaise nebuvome vieni
Gyvybės neišvengiamumas
Mirtino susiliejimo teorija
Prasiplečia gyvybės ribos
Gyvybės atsiradimas Žemėje
Lynn Margulis ir Gajos koncepcija
Kuo skiriasi žmogus ir gyvūnas?
Sibiras ir pirmieji amerikiečiai
Pasaulis, kūnas ir ... velnias: Daisonas
Kitokia žmogaus tvėrimo interpretacija
Už ką Nobelio premijos negavo Virginijus Šikšnys
Istorija apie Disnėjaus užšaldytą galvą
Alternatyvios žmogaus kilties teorijos
Panspermia: kosmoso užkratas
Naujausias kreacionizmo veidas
Ar kažkur Visatoje yra gyvybė?
Smegenys yra tampomi
Senasis mano kūnas
Didžioji pėda
Mąstymo aušra
Vartiklis